Proscar 5mg Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Proscar 5 mg et comment est-il utilisé ?
Proscar est un médicament d'ordonnance utilisé pour traiter les symptômes de l'hyperplasie bénigne de la prostate et de l'alopécie androgénique. Ce médicament est réservé aux hommes. Proscar 5 mg peut être utilisé seul ou avec d'autres médicaments.
Proscar appartient à une classe de médicaments appelés inhibiteurs de la 5-alpha-réductase.
On ne sait pas si Proscar 5 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Proscar 5mg ?
Proscar peut provoquer des effets secondaires graves, notamment :
- nausées sévères ou persistantes,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- nodules mammaires,
- douleur ou sensibilité mammaire,
- écoulement du mamelon et
- autres changements mammaires
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Proscar incluent :
- perte d'intérêt pour le sexe,
- impuissance,
- difficulté à avoir un orgasme, et
- éjaculation anormale
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Proscar. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
PROSCAR (finastéride), un composé 4-azastéroïde synthétique, est un inhibiteur spécifique de la 5α-réductase stéroïde de type II, une enzyme intracellulaire qui convertit la testostérone androgène en 5α-dihydrotestostérone (DHT).
Le finastéride est le 4-azaandrost-1-ène-17-carboxamide, N-(1,1-diméthyléthyl)-3-oxo-,(5α,17ß)-. La formule empirique du finastéride est C23H36N2O2 et son poids moléculaire est de 372,55. Sa formule structurale est :
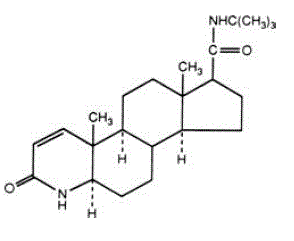
Le finastéride est une poudre cristalline blanche avec un point de fusion proche de 250°C. Il est librement soluble dans le chloroforme et dans les solvants alcooliques inférieurs, mais est pratiquement insoluble dans l'eau.
Les comprimés PROSCAR (finastéride) pour administration orale sont des comprimés pelliculés contenant 5 mg de finastéride et les ingrédients inactifs suivants : lactose hydraté, cellulose microcristalline, amidon prégélatinisé, glycolate d'amidon sodique, hydroxypropylcellulose LF, hydroxypropylméthylcellulose, dioxyde de titane, stéarate de magnésium. , talc, docusate sodique, laque d'aluminium FD&C bleu 2 et oxyde de fer jaune.
LES INDICATIONS
Monothérapie
PROSCAR® est indiqué pour le traitement de l'hyperplasie bénigne de la prostate (HBP) chez les hommes présentant une hypertrophie de la prostate pour :
- Améliorer les symptômes
- Réduire le risque de rétention urinaire aiguë
- Réduire le risque de recourir à une intervention chirurgicale, y compris la résection transurétrale de la prostate (TURP) et la prostatectomie.
Combinaison avec alpha-bloquant
PROSCAR 5 mg administré en association avec l'alpha-bloquant doxazosine est indiqué pour réduire le risque de progression symptomatique de l'HBP (une augmentation confirmée de ≥ 4 points du score des symptômes de l'American Urological Association (AUA)).
Limites d'utilisation
PROSCAR n'est pas approuvé pour la prévention du cancer de la prostate.
DOSAGE ET ADMINISTRATION
PROSCAR peut être administré avec ou sans repas.
Monothérapie
La dose recommandée de PROSCAR est d'un comprimé (5 mg) pris une fois par jour [voir Etudes cliniques ].
Combinaison avec alpha-bloquant
La dose recommandée de PROSCAR est d'un comprimé (5 mg) pris une fois par jour en association avec l'alpha-bloquant doxazosine [voir Etudes cliniques ].
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés pelliculés bleus, en forme de pomme modifiée, à 5 mg, portant le code MSD 72 d'un côté et PROSCAR 5 mg de l'autre.
Stockage et manutention
N° 3094 - Comprimés PROSCAR 5 mg sont des comprimés pelliculés bleus, modifiés en forme de pomme, portant le code MSD 72 sur une face et PROSCAR sur l'autre. Ils sont fournis comme suit :
CDN 0006-0072-31 unité d'utilisation flacons de 30 CDN 0006-0072-58 unité d'utilisation flacons de 100.
Stockage et manutention
Conserver à des températures ambiantes inférieures à 30 °C (86 °F). Protéger de la lumière et garder le récipient bien fermé.
Les femmes ne doivent pas manipuler les comprimés de PROSCAR 5 mg écrasés ou cassés lorsqu'elles sont enceintes ou pourraient être enceintes en raison de la possibilité d'absorption du finastéride et du risque potentiel ultérieur pour un fœtus mâle [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Distribué par : Merck Sharp & Dohme Corp., une filiale de MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Révisé : juin 2021
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Étude contrôlée par placebo de 4 ans (PLESS)
Dans PLESS, 1524 patients traités avec PROSCAR et 1516 patients traités avec un placebo ont été évalués pour la sécurité sur une période de 4 ans. Les effets indésirables les plus fréquemment rapportés étaient liés à la fonction sexuelle. 3,7 % (57 patients) traités par PROSCAR 5 mg et 2,1 % (32 patients) traités par placebo ont arrêté le traitement en raison d'effets indésirables liés à la fonction sexuelle, qui sont les effets indésirables les plus fréquemment rapportés.
Le tableau 1 présente les seuls effets indésirables cliniques considérés comme possiblement, probablement ou définitivement liés au médicament par l'investigateur, pour lesquels l'incidence sous PROSCAR 5 mg était ≥ 1 % et supérieure au placebo sur les 4 années de l'étude. Au cours des années 2 à 4 de l'étude, il n'y avait pas de différence significative entre les groupes de traitement dans l'incidence de l'impuissance, de la diminution de la libido et des troubles de l'éjaculation.
Études de phase III et prolongations ouvertes de 5 ans
Le profil d'effets indésirables dans les études de phase III contrôlées par placebo d'une durée d'un an, les extensions ouvertes de 5 ans et le PLESS étaient similaires.
Étude sur la thérapie médicale des symptômes prostatiques (MTOPS)
Dans l'étude MTOPS, 3 047 hommes atteints d'HBP symptomatique ont été randomisés pour recevoir PROSCAR 5 mg/jour (n=768), la doxazosine 4 ou 8 mg/jour (n=756), l'association de PROSCAR 5 mg/jour et de doxazosine 4 ou 8 mg/jour (n=786), ou placebo (n=737) pendant 4 à 6 ans. [Voir Etudes cliniques .]
Les taux d'incidence des effets indésirables liés au médicament rapportés par ≥ 2 % des patients dans n'importe quel groupe de traitement de l'étude MTOPS sont répertoriés dans le tableau 2.
Les effets indésirables individuels survenus plus fréquemment dans le groupe de l'association par rapport à l'un ou l'autre médicament seul étaient : asthénie, hypotension orthostatique, œdème périphérique, étourdissements, diminution de la libido, rhinite, éjaculation anormale, impuissance et fonction sexuelle anormale (voir tableau 2). Parmi ceux-ci, l'incidence de l'éjaculation anormale chez les patients recevant une polythérapie était comparable à la somme des incidences de cet effet indésirable rapporté pour les deux monothérapies.
Le traitement combiné avec le finastéride et la doxazosine n'a été associé à aucun nouvel effet indésirable clinique.
Quatre patientes de l'étude MTOPS ont signalé un cancer du sein ayant subi une expérience indésirable. Trois de ces patients étaient sous finastéride seul et un sous traitement combiné. [Voir Données à long terme .]
L'étude MTOPS n'a pas été spécifiquement conçue pour faire des comparaisons statistiques entre les groupes pour les effets indésirables rapportés. De plus, les comparaisons directes des données de sécurité entre l'étude MTOPS et les études précédentes des agents uniques peuvent ne pas être appropriées en fonction des différences dans la population de patients, la posologie ou le schéma posologique, et d'autres éléments de conception de la procédure et de l'étude.
Données à long terme
Cancer de la prostate de haut grade
L'essai PCPT était un essai randomisé, en double aveugle et contrôlé par placebo d'une durée de 7 ans qui a recruté 18 882 hommes âgés de 55 ans et plus avec un toucher rectal normal et un PSA ≤ 3,0 ng/mL. Les hommes ont reçu quotidiennement PROSCAR (finastéride 5 mg) ou un placebo. Les patients ont été évalués annuellement avec PSA et toucher rectal. Des biopsies ont été réalisées pour un PSA élevé, un toucher rectal anormal ou la fin de l'étude. L'incidence du cancer de la prostate avec un score de Gleason de 8 à 10 était plus élevée chez les hommes traités par finastéride (1,8 %) que chez ceux traités par placebo (1,1 %) [voir LES INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ]. Dans un essai clinique contrôlé par placebo de 4 ans avec un autre inhibiteur de la 5α-réductase (dutastéride, AVODART), des résultats similaires pour le cancer de la prostate avec un score de Gleason de 8 à 10 ont été observés (1 % de dutastéride contre 0,5 % de placebo).
Aucun bénéfice clinique n'a été démontré chez les patients atteints d'un cancer de la prostate traités par PROSCAR.
Cancer du sein
Au cours de l'étude MTOPS contrôlée par placebo et comparateur d'une durée de 4 à 6 ans qui a recruté 3047 hommes, il y a eu 4 cas de cancer du sein chez les hommes traités par le finastéride, mais aucun cas chez les hommes non traités par le finastéride. Au cours de l'étude PLESS de 4 ans, contrôlée par placebo, qui a recruté 3040 hommes, il y a eu 2 cas de cancer du sein chez les hommes traités par placebo, mais aucun cas chez les hommes traités par le finastéride. Au cours de l'essai de prévention du cancer de la prostate (PCPT) contrôlé par placebo de 7 ans qui a recruté 18 882 hommes, il y a eu 1 cas de cancer du sein chez les hommes traités par le finastéride et 1 cas de cancer du sein chez les hommes traités par placebo. La relation entre l'utilisation à long terme du finastéride et la néoplasie du sein chez l'homme est actuellement inconnue.
Fonction sexuelle
Il n'y a aucune preuve d'expériences indésirables sexuelles accrues avec une durée prolongée de traitement avec PROSCAR. Les nouveaux rapports d'expériences indésirables sexuelles liées à la drogue ont diminué avec la durée du traitement.
Expérience post-commercialisation
Les événements indésirables supplémentaires suivants ont été signalés après la commercialisation de PROSCAR. Étant donné que ces événements sont signalés volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament :
- réactions d'hypersensibilité, telles que prurit, urticaire et œdème de Quincke (y compris gonflement des lèvres, de la langue, de la gorge et du visage)
- douleur testiculaire
- hématospermie
- dysfonction sexuelle qui a persisté après l'arrêt du traitement, y compris dysfonction érectile, diminution de la libido et troubles de l'éjaculation (par exemple réduction du volume de l'éjaculat). Ces événements ont été signalés rarement chez les hommes prenant PROSCAR pour le traitement de l'HBP. La plupart des hommes étaient plus âgés et prenaient des médicaments concomitants et/ou souffraient de maladies comorbides. Le rôle indépendant de PROSCAR 5 mg dans ces événements est inconnu.
- de rares cas d'infertilité masculine et/ou de mauvaise qualité du sperme ont été signalés chez les hommes prenant PROSCAR 5 mg pour le traitement de l'HBP. Une normalisation ou une amélioration d'une mauvaise qualité séminale a été rapportée après l'arrêt du finastéride. Le rôle indépendant de PROSCAR dans ces événements est inconnu.
- la dépression
- cancer du sein masculin.
L'événement indésirable supplémentaire suivant lié au dysfonctionnement sexuel qui a persisté après l'arrêt du traitement a été rapporté dans l'expérience post-commercialisation avec le finastéride à des doses plus faibles utilisées pour traiter la calvitie masculine. Étant donné que l'événement est signalé volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable sa fréquence ou d'établir une relation causale avec l'exposition au médicament :
- troubles de l'orgasme
INTERACTIONS MÉDICAMENTEUSES
Système enzymatique de métabolisation des médicaments lié au cytochrome P450
Aucune interaction médicamenteuse d'importance clinique n'a été identifiée. Le finastéride ne semble pas affecter le système enzymatique de métabolisation des médicaments lié au cytochrome P450. Les composés qui ont été testés chez l'homme ont inclus l'antipyrine, la digoxine, le propranolol, la théophylline et la warfarine et aucune interaction cliniquement significative n'a été trouvée.
Autre thérapie concomitante
Bien qu'aucune étude d'interaction spécifique n'ait été réalisée, PROSCAR 5 mg a été utilisé en concomitance dans des études cliniques avec de l'acétaminophène, de l'acide acétylsalicylique, des α-bloquants, des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), des analgésiques, des anticonvulsivants, des agents bloquants bêta-adrénergiques, des diurétiques, du calcium les inhibiteurs des canaux, les nitrates cardiaques, les inhibiteurs de l'HMG-CoA réductase, les anti-inflammatoires non stéroïdiens (AINS), les benzodiazépines, les antagonistes H2 et les anti-infectieux quinolones sans preuve d'interactions indésirables cliniquement significatives.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Effets sur l'antigène spécifique de la prostate (PSA) et l'utilisation du PSA dans la détection du cancer de la prostate
Dans les études cliniques, PROSCAR a réduit la concentration sérique de PSA d'environ 50 % dans les six mois suivant le traitement. Cette diminution est prévisible sur toute la gamme des valeurs de PSA chez les patients atteints d'HBP symptomatique, bien qu'elle puisse varier d'un individu à l'autre.
Pour l'interprétation des PSA en série chez les hommes prenant PROSCAR, une nouvelle ligne de base de PSA doit être établie au moins six mois après le début du traitement et le PSA doit être surveillé périodiquement par la suite. Toute augmentation confirmée par rapport à la valeur de PSA la plus basse sous PROSCAR 5 mg peut signaler la présence d'un cancer de la prostate et doit être évaluée, même si les taux de PSA sont toujours dans la plage normale pour les hommes ne prenant pas d'inhibiteur de la 5α réductase. La non-observance du traitement PROSCAR peut également affecter les résultats du test PSA. Pour interpréter une valeur de PSA isolée chez les patients traités avec PROSCAR 5 mg pendant six mois ou plus, les valeurs de PSA doivent être doublées pour être comparées aux plages normales chez les hommes non traités. Ces ajustements préservent l'utilité du PSA pour détecter le cancer de la prostate chez les hommes traités par PROSCAR.
PROSCAR peut également entraîner une diminution du PSA sérique en présence d'un cancer de la prostate.
Le rapport PSA libre/PSA total (pourcentage de PSA libre) reste constant même sous l'influence de PROSCAR. Si les cliniciens choisissent d'utiliser le pourcentage de PSA libre comme aide à la détection du cancer de la prostate chez les hommes sous traitement par le finastéride, aucun ajustement de sa valeur ne semble nécessaire.
Risque accru de cancer de la prostate de haut grade
Les hommes âgés de 55 ans et plus avec un toucher rectal normal et un PSA ≤ 3,0 ng/mL au départ prenant du finastéride à 5 mg/jour dans le cadre de l'essai de 7 ans sur la prévention du cancer de la prostate (PCPT) présentaient un risque accru de cancer de la prostate avec un score de Gleason de 8 à 10 (finastéride 1,8 % contre placebo 1,1 %). [Voir LES INDICATIONS et EFFETS INDÉSIRABLES .] Des résultats similaires ont été observés dans un essai clinique contrôlé par placebo de 4 ans avec un autre inhibiteur de la 5α-réductase (dutastéride, AVODART) (1 % de dutastéride contre 0,5 % de placebo). Les inhibiteurs de la 5αréductase peuvent augmenter le risque de développement d'un cancer de la prostate de haut grade. Il n'a pas été établi si l'effet des inhibiteurs de la 5α-réductase pour réduire le volume de la prostate ou des facteurs liés à l'étude ont eu un impact sur les résultats de ces études.
Exposition des femelles
Risque pour le fœtus masculin
PROSCAR est contre-indiqué chez les femmes enceintes et chez les femmes susceptibles d'être enceintes et n'est pas indiqué chez les femmes. Sur la base d'études animales et du mécanisme d'action, PROSCAR 5 mg peut provoquer un développement anormal des organes génitaux externes chez un fœtus masculin s'il est administré à une femme enceinte. Les femmes enceintes ou potentiellement enceintes ne doivent pas manipuler les comprimés PROSCAR 5 mg écrasés ou cassés. Les comprimés PROSCAR 5 mg sont enrobés et empêcheront tout contact avec le principe actif lors d'une manipulation normale, à condition que les comprimés n'aient pas été cassés ou écrasés. Si une femme enceinte entre en contact avec des comprimés de PROSCAR 5 mg écrasés ou cassés, la zone de contact doit être immédiatement lavée à l'eau et au savon. [Voir CONTRE-INDICATIONS ,UN Utilisation dans des populations spécifiques ,UN PHARMACOLOGIE CLINIQUE , et COMMENT FOURNIE .]
Patients pédiatriques et femmes
PROSCAR n'est pas indiqué chez les patients pédiatriques [voir Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ] ou femelles [voir aussi AVERTISSEMENTS ET PRECAUTIONS ,UN Utilisation dans des populations spécifiques ,UN PHARMACOLOGIE CLINIQUE , et COMMENT FOURNIE ].
Effet sur les caractéristiques du sperme
Le traitement avec PROSCAR pendant 24 semaines pour évaluer les paramètres du sperme chez des volontaires sains de sexe masculin n'a révélé aucun effet cliniquement significatif sur la concentration, la mobilité, la morphologie ou le pH des spermatozoïdes. Une diminution médiane de 0,6 ml (22,1 %) du volume de l'éjaculat avec une réduction concomitante du nombre total de spermatozoïdes par éjaculat a été observée. Ces paramètres sont restés dans la plage normale et étaient réversibles à l'arrêt du traitement avec un délai moyen de retour à la ligne de base de 84 semaines.
Considération d'autres conditions urologiques
Avant d'initier un traitement par PROSCAR 5 mg, il convient de tenir compte d'autres affections urologiques susceptibles de provoquer des symptômes similaires. De plus, le cancer de la prostate et l'HBP peuvent coexister.
Les patients présentant un volume urinaire résiduel important et/ou un débit urinaire sévèrement diminué doivent être étroitement surveillés pour une uropathie obstructive. Ces patients peuvent ne pas être candidats au traitement par le finastéride.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Risque accru de cancer de la prostate de haut grade
Les patients doivent être informés qu'il y a eu une augmentation du cancer de la prostate de haut grade chez les hommes traités avec des inhibiteurs de la 5α-réductase indiqués pour le traitement de l'HBP, y compris PROSCAR 5 mg, par rapport à ceux traités avec un placebo dans les études examinant l'utilisation de ces médicaments pour prévenir la prostate. cancer [voir LES INDICATIONS ,UN AVERTISSEMENTS ET PRECAUTIONS , et EFFETS INDÉSIRABLES ].
Exposition des femelles - Risque pour le fœtus mâle
Les médecins doivent informer les patientes que les femmes enceintes ou susceptibles de l'être ne doivent pas manipuler les comprimés PROSCAR écrasés ou brisés en raison de la possibilité d'absorption du finastéride et du risque potentiel subséquent pour le fœtus masculin. Les comprimés PROSCAR sont enrobés et empêcheront tout contact avec l'ingrédient actif lors d'une manipulation normale, à condition que les comprimés n'aient pas été brisés ou écrasés. Si une femme enceinte ou potentiellement enceinte entre en contact avec des comprimés PROSCAR écrasés ou cassés, la zone de contact doit être immédiatement lavée à l'eau et au savon [voir CONTRE-INDICATIONS ,UN AVERTISSEMENTS ET PRECAUTIONS ,UN Utilisation dans des populations spécifiques et COMMENT FOURNIE ].
instructions additionnelles
Les médecins doivent informer les patients que le volume de l'éjaculat peut être diminué chez certains patients pendant le traitement par PROSCAR. Cette diminution ne semble pas interférer avec la fonction sexuelle normale. Cependant, l'impuissance et la diminution de la libido peuvent survenir chez les patients traités par PROSCAR [voir EFFETS INDÉSIRABLES ].
Les médecins doivent demander à leurs patientes de signaler rapidement tout changement dans leurs seins, comme des grosseurs, des douleurs ou un écoulement des mamelons. Des modifications mammaires, notamment une hypertrophie mammaire, une sensibilité et un néoplasme, ont été signalées [voir EFFETS INDÉSIRABLES ].
Les médecins doivent demander à leurs patients de lire la notice d'accompagnement du patient avant de commencer le traitement par PROSCAR 5 mg et de la relire chaque fois que la prescription est renouvelée afin qu'ils soient au courant des informations actuelles pour les patients concernant PROSCAR.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Aucun signe d'effet tumorigène n'a été observé dans une étude de 24 mois chez des rats Sprague-Dawley recevant des doses de finastéride allant jusqu'à 160 mg/kg/jour chez les mâles et 320 mg/kg/jour chez les femelles. Ces doses ont produit une exposition systémique respective chez le rat de 111 et 274 fois celle observée chez l'homme recevant la dose humaine recommandée de 5 mg/jour. Tous les calculs d'exposition étaient basés sur l'ASC calculée (0-24 h) pour les animaux et l'ASC moyenne (0-24 h) pour l'homme (0,4 μg•h/mL).
Dans une étude de cancérogénicité de 19 mois chez des souris CD-1, une augmentation statistiquement significative (p≤0,05) de l'incidence des adénomes à cellules de Leydig testiculaires a été observée à 228 fois l'exposition humaine (250 mg/kg/jour). Chez les souris à 23 fois l'exposition humaine, estimée (25 mg/kg/jour) et chez les rats à 39 fois l'exposition humaine (40 mg/kg/jour), une augmentation de l'incidence de l'hyperplasie des cellules de Leydig a été observée. Une corrélation positive entre les changements prolifératifs dans les cellules de Leydig et une augmentation des taux sériques de LH (2 à 3 fois au-dessus du contrôle) a été démontrée chez les deux espèces de rongeurs traitées avec de fortes doses de finastéride. Aucune modification des cellules de Leydig liée au médicament n'a été observée chez les rats ou les chiens traités avec le finastéride pendant 1 an à 30 et 350 fois (20 mg/kg/jour et 45 mg/kg/jour, respectivement) ou chez les souris traitées pendant 19 mois à 2,3 fois l'exposition humaine, estimée (2,5 mg/kg/jour).
Mutagenèse
Aucune preuve de mutagénicité n'a été observée dans un test de mutagenèse bactérienne in vitro, un test de mutagenèse sur des cellules de mammifères ou un test d'élution alcaline in vitro. Dans un test d'aberration chromosomique in vitro, utilisant des cellules ovariennes de hamster chinois, il y a eu une légère augmentation des aberrations chromosomiques. Ces concentrations correspondent à 4 000 à 5 000 fois les concentrations plasmatiques maximales chez l'homme ayant reçu une dose totale de 5 mg. Dans un test d'aberration chromosomique in vivo chez la souris, aucune augmentation de l'aberration chromosomique liée au traitement n'a été observée avec le finastéride à la dose maximale tolérée de 250 mg/kg/jour (228 fois l'exposition humaine) comme déterminé dans les études de cancérogénicité.
Altération de la fertilité
Chez des lapins mâles sexuellement matures traités avec du finastéride à 543 fois l'exposition humaine (80 mg/kg/jour) pendant jusqu'à 12 semaines, aucun effet sur la fertilité, la numération des spermatozoïdes ou le volume de l'éjaculat n'a été observé. Chez les rats mâles sexuellement matures traités avec 61 fois l'exposition humaine (80 mg/kg/jour), il n'y a eu aucun effet significatif sur la fertilité après 6 ou 12 semaines de traitement ; cependant, lorsque le traitement a été poursuivi jusqu'à 24 ou 30 semaines, il y a eu une diminution apparente de la fertilité, de la fécondité et une diminution significative associée du poids des vésicules séminales et de la prostate. Tous ces effets ont été réversibles dans les 6 semaines suivant l'arrêt du traitement. Aucun effet lié au médicament sur les testicules ou sur les performances d'accouplement n'a été observé chez le rat ou le lapin. Cette diminution de la fertilité chez les rats traités par le finastéride est secondaire à son effet sur les organes sexuels accessoires (prostate et vésicules séminales) entraînant l'échec de la formation d'un bouchon séminal. Le bouchon séminal est essentiel pour une fertilité normale chez le rat et n'est pas pertinent chez l'homme.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
PROSCAR est contre-indiqué chez les femmes enceintes et n'est pas indiqué chez les femmes. Sur la base d'études animales et du mécanisme d'action, PROSCAR 5 mg peut provoquer un développement anormal des organes génitaux externes chez un fœtus masculin s'il est administré à une femme enceinte [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Dans une étude sur le développement embryo-fœtal chez le rat, une augmentation dose-dépendante de l'hypospadias s'est produite chez 3,6 à 100 % des descendants mâles de rates gravides ayant reçu du finastéride par voie orale pendant la période d'organogenèse majeure à des doses d'environ 0,1 à 86 fois la dose maximale. dose humaine recommandée (MRHD) de 5 mg/jour (sur la base de l'ASC à des doses animales de 0,1 à 100 mg/kg/jour).
Une diminution du poids des vésicules prostatiques et séminales, une séparation préputiale retardée et un développement transitoire du mamelon ont également été observés chez la progéniture mâle à des doses maternelles orales d'environ 0,03 fois la MRHD (sur la base de l'ASC à une dose animale de 0,03 mg/kg/jour), ainsi qu'une diminution de la distance anogénitale dans la progéniture mâle aux doses maternelles orales environ 0.003 fois le MRHD (basé sur AUC à la dose animale de 0.003 mgs/kg/jours).
PROSCAR est un inhibiteur de la 5α-réductase de type II qui empêche la conversion de la testostérone en 5α-dihydrotestostérone (DHT), une hormone nécessaire au développement normal des organes génitaux masculins. Si ce médicament est utilisé pendant la grossesse, ou si la patiente tombe enceinte pendant qu'elle prend ce médicament, la patiente doit être informée du risque potentiel pour le fœtus de sexe masculin.
Le développement génital masculin anormal est une conséquence attendue lorsque la conversion de la testostérone en 5α-dihydrotestostérone (DHT) est inhibée par les inhibiteurs de la 5α-réductase. Ces résultats sont similaires à ceux rapportés chez les nourrissons de sexe masculin présentant un déficit génétique en 5α-réductase. Les femmes pourraient être exposées au finastéride par contact avec des comprimés PROSCAR écrasés ou brisés ou le sperme d'un partenaire masculin prenant PROSCAR. En ce qui concerne l'exposition au finastéride par la peau, les comprimés PROSCAR 5 mg sont enrobés et empêcheront le contact cutané avec le finastéride lors d'une manipulation normale si les comprimés n'ont pas été écrasés ou cassés. Les femmes enceintes ou potentiellement enceintes ne doivent pas manipuler les comprimés PROSCAR 5 mg écrasés ou cassés en raison de l'exposition possible d'un fœtus mâle. En ce qui concerne l'exposition potentielle au finastéride par le sperme, trois études ont été menées qui ont mesuré les concentrations de finastéride dans le sperme d'hommes recevant PROSCAR 5 mg/jour. Dans ces études, la quantité la plus élevée de finastéride dans le sperme a été estimée à 50 à 100 fois moins que la dose de finastéride (5 μg) qui n'a eu aucun effet sur les taux de DHT circulants chez les hommes [voir Données et PHARMACOLOGIE CLINIQUE ].
Données
Données humaines
Dans 2 études portant sur des sujets sains (n = 69) recevant PROSCAR 5 mg/jour pendant 6 à 24 semaines, les concentrations de finastéride dans le sperme variaient d'indétectables ( PHARMACOLOGIE CLINIQUE ].
Données animales
Dans une étude sur le développement embryo-fœtal, des rates gravides ont reçu du finastéride pendant la période d'organogenèse majeure (jours de gestation 6 à 17). À des doses maternelles de finastéride par voie orale d'environ 0,1 à 86 fois la dose humaine maximale recommandée (MRHD) de 5 mg/jour (sur la base de l'ASC à des doses animales de 0,1 à 100 mg/kg/jour), il y a eu une augmentation dose-dépendante de l'hypospadias cela s'est produit chez 3,6 à 100% des descendants mâles. Les multiples d'exposition ont été estimés à l'aide de données provenant de rats non gravides. Les jours 16 à 17 de gestation sont une période critique chez les rats fœtaux mâles pour la différenciation des organes génitaux externes. À des doses maternelles orales d'environ 0,03 fois la MRHD (sur la base de l'ASC à une dose animale de 0,03 mg/kg/jour), la progéniture mâle présentait une diminution du poids des vésicules prostatiques et séminales, une séparation préputiale retardée et un développement transitoire du mamelon. La distance anogenital diminuée s'est produite dans la progéniture mâle de rats enceintes qui ont reçu environ 0.003 fois le MRHD (basé sur AUC à la dose animale de 0.003 mgs/kg/jours). Aucune anomalie n'a été observée chez la progéniture femelle à n'importe quelle dose maternelle de finastéride.
Aucune anomalie du développement n'a été observée dans la progéniture de femelles non traitées accouplées avec des rats mâles traités au finastéride qui ont reçu environ 61 fois la MRHD (basée sur l'ASC à une dose animale de 80 mg/kg/jour). Une fertilité légèrement diminuée a été observée chez la progéniture mâle après l'administration d'environ 3 fois la MRHD (basée sur l'ASC à une dose animale de 3 mg/kg/jour) à des rats femelles en fin de gestation et de lactation. Aucun effet sur la fertilité n'a été observé chez la progéniture femelle dans ces conditions.
Aucun signe de malformations génitales externes mâles ou d'autres anomalies n'a été observé chez les fœtus de lapin exposés au finastéride pendant la période d'organogenèse majeure (jours de gestation 6-18) à des doses maternelles orales allant jusqu'à 100 mg/kg/jour (les niveaux d'exposition au finastéride n'ont pas été mesuré chez le lapin). Cependant, cette étude n'a peut-être pas inclus la période critique des effets du finastéride sur le développement des organes génitaux externes mâles chez le lapin.
Les effets fœtaux de l'exposition maternelle au finastéride pendant la période de développement embryonnaire et fœtal ont été évalués chez le singe rhésus (jours de gestation 20-100), dans une espèce et une période de développement plus prédictives d'effets spécifiques chez l'homme que les études chez le rat et le lapin. L'administration intraveineuse de finastéride à des singes gravides à des doses aussi élevées que 800 ng/jour (concentration sanguine maximale estimée à 1,86 ng/mL ou environ 143 fois l'exposition estimée la plus élevée des femelles gravides au finastéride provenant du sperme d'hommes prenant 5 mg/jour) a entraîné aucune anomalie chez les fœtus mâles. Afin de confirmer la pertinence du modèle rhésus pour le développement fœtal humain, l'administration orale d'une dose de finastéride (2 mg/kg/jour ou environ 18 000 fois les taux sanguins estimés les plus élevés de finastéride provenant du sperme d'hommes prenant 5 mg/jour) à les singes enceintes ont entraîné des anomalies génitales externes chez les fœtus mâles. Aucune autre anomalie n'a été observée chez les fœtus mâles et aucune anomalie liée au finastéride n'a été observée chez les fœtus femelles, quelle que soit la dose.
Lactation
Résumé des risques
PROSCAR n'est pas indiqué chez les femmes.
Femelles et mâles de potentiel reproducteur
Infertilité
Femelles
PROSCAR n'est pas indiqué chez les femmes.
Mâles
Le traitement avec PROSCAR pendant 24 semaines pour évaluer les paramètres du sperme chez des volontaires sains de sexe masculin n'a révélé aucun effet cliniquement significatif sur la concentration, la mobilité, la morphologie ou le pH des spermatozoïdes. Une diminution médiane de 0,6 ml (22,1 %) du volume de l'éjaculat avec une réduction concomitante du nombre total de spermatozoïdes par éjaculat a été observée. Ces paramètres sont restés dans la plage normale et étaient réversibles à l'arrêt du traitement avec un délai moyen de retour à la ligne de base de 84 semaines [voir AVERTISSEMENTS ET PRECAUTIONS ].
Des cas d'infertilité masculine et/ou de mauvaise qualité séminale ont été signalés après commercialisation; une normalisation ou une amélioration de la qualité séminale a été rapportée après l'arrêt du finastéride [voir EFFETS INDÉSIRABLES ].
Utilisation pédiatrique
PROSCAR 5 mg n'est pas indiqué chez les patients pédiatriques.
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Sur le nombre total de sujets inclus dans le PLESS, 1480 et 105 sujets avaient respectivement 65 ans et plus et 75 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences de réponses entre les patients âgés et les patients plus jeunes. Aucun ajustement posologique n'est nécessaire chez les personnes âgées [voir PHARMACOLOGIE CLINIQUE et Etudes cliniques ].
Insuffisance hépatique
La prudence s'impose lors de l'administration de PROSCAR chez les patients présentant des anomalies de la fonction hépatique, car le finastéride est largement métabolisé dans le foie [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les patients insuffisants rénaux [voir PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Les patients ont reçu des doses uniques de PROSCAR 5 mg jusqu'à 400 mg et des doses multiples de PROSCAR 5 mg jusqu'à 80 mg/jour pendant trois mois sans effets indésirables. Jusqu'à l'obtention d'une expérience plus approfondie, aucun traitement spécifique pour un surdosage avec PROSCAR ne peut être recommandé.
Une létalité significative a été observée chez les souris mâles et femelles à des doses orales uniques de 1500 mg/m2 (500 mg/kg) et chez les rats femelles et mâles à des doses orales uniques de 2360 mg/m2 (400 mg/kg) et 5900 mg/m2. (1000 mg/kg), respectivement.
CONTRE-INDICATIONS
PROSCAR est contre-indiqué dans les cas suivants :
- Hypersensibilité à l'un des composants de ce médicament.
- Grossesse. L'utilisation du finastéride est contre-indiquée chez les femmes lorsqu'elles sont ou pourraient être enceintes. En raison de la capacité des inhibiteurs de la 5α-réductase de type II à inhiber la conversion de la testostérone en 5α-dihydrotestostérone (DHT), le finastéride peut provoquer des anomalies des organes génitaux externes du fœtus masculin d'une femme enceinte qui reçoit du finastéride. Si ce médicament est utilisé pendant la grossesse, ou si une grossesse survient pendant la prise de ce médicament, la femme enceinte doit être informée du danger potentiel pour le fœtus mâle. [Voir aussi AVERTISSEMENTS ET PRECAUTIONS ,UN Utilisation dans des populations spécifiques , et COMMENT FOURNIE .] Chez les rats femelles, de faibles doses de finastéride administrées pendant la grossesse ont produit des anomalies des organes génitaux externes chez la progéniture mâle.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le développement et l'élargissement de la prostate dépendent du puissant androgène 5α-dihydrotestostérone (DHT). La 5α-réductase de type II métabolise la testostérone en DHT dans la prostate, le foie et la peau. La DHT induit des effets androgéniques en se liant aux récepteurs des androgènes dans les noyaux cellulaires de ces organes.
Le finastéride est un inhibiteur compétitif et spécifique de la 5α-réductase de type II avec laquelle il forme lentement un complexe enzymatique stable. Le chiffre d'affaires de ce complexe est extrêmement lent (t½ ∼ 30 jours). Cela a été démontré à la fois in vivo et in vitro. Le finastéride n'a aucune affinité pour le récepteur aux androgènes. Chez l'homme, les métabolites stéroïdiens réduits en 5α dans le sang et l'urine sont diminués après l'administration de finastéride.
Pharmacodynamie
Chez l'homme, une dose orale unique de 5 mg de PROSCAR produit une réduction rapide de la concentration sérique de DHT, avec un effet maximal observé 8 heures après la première dose. La suppression de la DHT est maintenue tout au long de l'intervalle de dosage de 24 heures et avec la poursuite du traitement. Il a été démontré qu'une administration quotidienne de PROSCAR à 5 mg/jour pendant jusqu'à 4 ans réduit la concentration sérique de DHT d'environ 70 %. Le taux circulant médian de testostérone a augmenté d'environ 10 à 20 % mais est resté dans la plage physiologique. Dans une étude distincte chez des hommes en bonne santé traités avec du finastéride 1 mg par jour (n = 82) ou un placebo (n = 69), les taux circulants moyens de testostérone et d'estradiol ont augmenté d'environ 15 % par rapport à la valeur initiale, mais ils sont restés dans les limites plage physiologique.
Chez les patients recevant PROSCAR 5 mg/jour, des augmentations d'environ 10 % ont été observées dans l'hormone lutéinisante (LH) et l'hormone folliculo-stimulante (FSH), mais les niveaux sont restés dans la plage normale. Chez des volontaires sains, le traitement par PROSCAR 5 mg n'a pas modifié la réponse de la LH et de la FSH à l'hormone de libération des gonadotrophines, indiquant que l'axe hypothalamo-hypophyso-testiculaire n'était pas affecté.
Chez les patients atteints d'HBP, PROSCAR n'a aucun effet sur les taux circulants de cortisol, de prolactine, d'hormone stimulant la thyroïde ou de thyroxine. Aucun effet cliniquement significatif n'a été observé sur le profil lipidique plasmatique (c.-à-d. cholestérol total, lipoprotéines de basse densité, lipoprotéines de haute densité et triglycérides) ou sur la densité minérale osseuse.
Les hommes adultes atteints d'un déficit génétiquement hérité en 5α-réductase de type II ont également des taux de DHT réduits. À l'exception des anomalies urogénitales associées présentes à la naissance, aucune autre anomalie clinique liée au déficit en 5α-réductase de type II n'a été observée chez ces personnes. Ces personnes ont une petite prostate tout au long de leur vie et ne développent pas d'HBP.
Chez les patients atteints d'HBP traités par le finastéride (1-100 mg/jour) pendant 7 à 10 jours avant la prostatectomie, une teneur en DHT inférieure d'environ 80 % a été mesurée dans le tissu prostatique retiré lors de la chirurgie, par rapport au placebo ; la concentration tissulaire de testostérone a été augmentée jusqu'à 10 fois par rapport aux niveaux de prétraitement, par rapport au placebo. Le contenu intraprostatique de PSA était également diminué.
Chez des volontaires masculins en bonne santé traités avec PROSCAR 5 mg pendant 14 jours, l'arrêt du traitement a entraîné un retour des niveaux de DHT aux niveaux de prétraitement en environ 2 semaines. Chez les patients traités pendant trois mois, le volume de la prostate, qui avait diminué d'environ 20 %, est revenu à une valeur proche de la valeur initiale après environ trois mois d'arrêt du traitement.
Pharmacocinétique
Absorption
Dans une étude portant sur 15 jeunes sujets en bonne santé, la biodisponibilité moyenne des comprimés de finastéride à 5 mg était de 63 % (intervalle de 34 à 108 %), sur la base du rapport de l'aire sous la courbe (ASC) par rapport à une dose de référence intraveineuse (IV). . La concentration plasmatique maximale de finastéride était en moyenne de 37 ng/mL (intervalle de 27 à 49 ng/mL) et a été atteinte 1 à 2 heures après l'administration. La biodisponibilité du finastéride n'a pas été affectée par la nourriture.
Distribution
Le volume de distribution moyen à l'état d'équilibre était de 76 litres (intervalle, 44-96 litres). Environ 90 % du finastéride circulant est lié aux protéines plasmatiques. Il y a une phase d'accumulation lente du finastéride après plusieurs doses. Après administration de 5 mg/jour de finastéride pendant 17 jours, les concentrations plasmatiques de finastéride étaient de 47 et 54 % plus élevées qu'après la première dose chez les hommes âgés de 45 à 60 ans (n = 12) et ≥ 70 ans (n = 12) , respectivement. Les concentrations minimales moyennes après 17 jours d'administration étaient de 6,2 ng/mL (intervalle, 2,49,8 ng/mL) et 8,1 ng/mL (intervalle, 1,8-19,7 ng/mL), respectivement, dans les deux groupes d'âge. Bien que l'état d'équilibre n'ait pas été atteint dans cette étude, la concentration plasmatique minimale moyenne dans une autre étude chez des patients atteints d'HBP (âge moyen : 65 ans) recevant 5 mg/jour était de 9,4 ng/mL (intervalle : 7,1-13,3 ng/mL ; n= 22) après plus d'un an de traitement.
Il a été démontré que le finastéride traverse la barrière hémato-encéphalique mais ne semble pas se distribuer préférentiellement dans le LCR.
Dans 2 études portant sur des sujets sains (n = 69) recevant PROSCAR 5 mg/jour pendant 6 à 24 semaines, les concentrations de finastéride dans le sperme variaient d'indétectables ( Utilisation dans des populations spécifiques ].
Métabolisme
Le finastéride est largement métabolisé dans le foie, principalement via la sous-famille des enzymes du cytochrome P450 3A4. Deux métabolites, les métabolites monohydroxylés de la chaîne latérale t-butyle et les acides monocarboxyliques, ont été identifiés et ne possèdent pas plus de 20 % de l'activité inhibitrice de la 5α-réductase du finastéride.
Excrétion
Chez les jeunes sujets sains (n = 15), la clairance plasmatique moyenne du finastéride était de 165 ml/min (intervalle, 70279 ml/min) et la demi-vie d'élimination moyenne dans le plasma était de 6 heures (intervalle, 3-16 heures). Suite à une dose orale de 14C-finastéride chez l'homme (n = 6), une moyenne de 39 % (extrêmes, 32-46 %) de la dose a été excrétée dans l'urine sous forme de métabolites ; 57 % (intervalle, 51-64 %) ont été excrétés dans les fèces.
La demi-vie terminale moyenne du finastéride chez les sujets âgés de ≥ 70 ans était d'environ 8 heures (intervalle, 6-15 heures ; n = 12), contre 6 heures (intervalle, 4-12 heures ; n = 12) chez les sujets 45-60 ans. Par conséquent, l'ASC moyenne (0-24 heures) après 17 jours d'administration était 15 % plus élevée chez les sujets âgés de ≥ 70 ans que chez les sujets âgés de 45 à 60 ans (p = 0,02).
Pédiatrique
La pharmacocinétique du finastéride n'a pas été étudiée chez les patients de moins de 18 ans.
Le finastéride n'est pas indiqué chez les patients pédiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ,UN Utilisation dans des populations spécifiques ].
Le genre
Le finastéride n'est pas indiqué chez les femmes [voir CONTRE-INDICATIONS ,UN AVERTISSEMENTS ET PRECAUTIONS ,UN Utilisation dans des populations spécifiques , et COMMENT FOURNIE ].
Gériatrique
Aucun ajustement posologique n'est nécessaire chez la personne âgée. Bien que le taux d'élimination du finastéride soit diminué chez les personnes âgées, ces résultats n'ont aucune signification clinique. [Voir Pharmacocinétique et Utilisation dans des populations spécifiques .]
Course
L'effet de la race sur la pharmacocinétique du finastéride n'a pas été étudié.
Insuffisance hépatique
L'effet de l'insuffisance hépatique sur la pharmacocinétique du finastéride n'a pas été étudié. La prudence s'impose lors de l'administration de PROSCAR 5 mg chez les patients présentant des anomalies de la fonction hépatique, car le finastéride est largement métabolisé dans le foie. Insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les insuffisants rénaux. Chez les patients atteints d'insuffisance rénale chronique, avec des clairances de la créatinine allant de 9,0 à 55 ml/min, l'ASC, la concentration plasmatique maximale, la demi-vie et la liaison aux protéines après une dose unique de 14C-finastéride étaient similaires aux valeurs obtenues chez des volontaires sains. L'excrétion urinaire des métabolites a diminué chez les patients atteints d'insuffisance rénale. Cette diminution était associée à une augmentation de l'excrétion fécale des métabolites. Les concentrations plasmatiques des métabolites étaient significativement plus élevées chez les patients insuffisants rénaux (sur la base d'une augmentation de 60 % de l'ASC de la radioactivité totale). Cependant, le finastéride a été bien toléré chez les patients atteints d'HBP avec une fonction rénale normale recevant jusqu'à 80 mg/jour pendant 12 semaines, où l'exposition de ces patients aux métabolites serait probablement beaucoup plus importante.
Etudes cliniques
Monothérapie
PROSCAR 5 mg/jour a été initialement évalué chez des patients présentant des symptômes d'HBP et une hypertrophie de la prostate par toucher rectal dans deux études randomisées en double aveugle contrôlées par placebo d'une durée d'un an et leurs extensions ouvertes de 5 ans.
PROSCAR 5 mg a fait l'objet d'une évaluation plus approfondie dans le cadre de l'étude d'efficacité et d'innocuité à long terme PROSCAR (PLESS), une étude multicentrique à double insu, randomisée, contrôlée par placebo et d'une durée de 4 ans. 3040 patients âgés de 45 à 78 ans, présentant des symptômes modérés à sévères d'HBP et une hypertrophie de la prostate au toucher rectal, ont été randomisés dans l'étude (1524 pour le finastéride, 1516 pour le placebo) et 3016 patients étaient évaluables pour l'efficacité. 1883 patients ont terminé l'étude de 4 ans (1000 dans le groupe finastéride, 883 dans le groupe placebo).
Effet sur le score des symptômes
Les symptômes ont été quantifiés à l'aide d'un score similaire à l'American Urological Association Symptom Score, qui évaluait à la fois les symptômes obstructifs (altération de la taille et de la force du jet, sensation de vidange incomplète de la vessie, miction retardée ou interrompue) et les symptômes irritatifs (nycturie, fréquence diurne, besoin forcer ou pousser le flux d'urine) en évaluant sur une échelle de 0 à 5 pour six symptômes et une échelle de 0 à 4 pour un symptôme, pour un score total possible de 34.
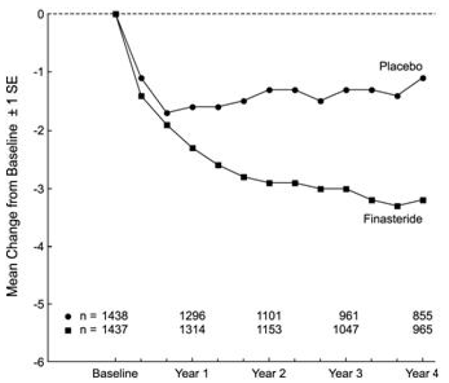
Les patients du PLESS présentaient des symptômes modérés à sévères au départ (moyenne d'environ 15 points sur une échelle de 0 à 34 points). Les patients randomisés pour recevoir PROSCAR qui sont restés sous traitement pendant 4 ans ont présenté une diminution moyenne (± 1 SD) du score des symptômes de 3,3 (± 5,8) points par rapport à 1,3 (± 5,6) points dans le groupe placebo. (Voir la figure 1.) Une amélioration statistiquement significative du score des symptômes était évidente à 1 an chez les patients traités par PROSCAR par rapport au placebo (-2,3 contre -1,6), et cette amélioration s'est poursuivie jusqu'à la 4ème année.
Figure 1 Score des symptômes dans le PLESS
Les résultats observés dans les études antérieures étaient comparables à ceux observés dans le PLESS. Bien qu'une amélioration précoce des symptômes urinaires ait été observée chez certains patients, un essai thérapeutique d'au moins 6 mois était généralement nécessaire pour évaluer si une réponse bénéfique dans le soulagement des symptômes avait été obtenue. L'amélioration des symptômes de l'HBP a été observée au cours de la première année et s'est maintenue tout au long de 5 années supplémentaires d'études d'extension ouvertes.
Effet sur la rétention urinaire aiguë et la nécessité d'une intervention chirurgicale
Dans PLESS, l'efficacité a également été évaluée en évaluant les échecs thérapeutiques. L'échec du traitement a été défini de manière prospective comme des événements urologiques liés à l'HBP ou une détérioration clinique, une absence d'amélioration et/ou la nécessité d'un traitement alternatif. Les événements urologiques liés à l'HBP ont été définis comme une intervention chirurgicale urologique et une rétention urinaire aiguë nécessitant un cathétérisme. Des informations complètes sur les événements étaient disponibles pour 92 % des patients. Le tableau suivant (tableau 5) résume les résultats.
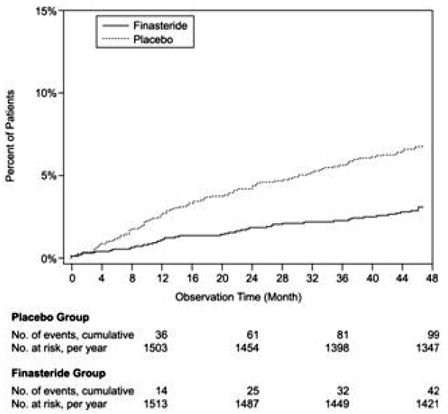
Comparé au placebo, PROSCAR a été associé à un risque significativement plus faible de rétention urinaire aiguë ou de nécessité de chirurgie liée à l'HBP [13,2 % pour le placebo contre 6,6 % pour PROSCAR ; Réduction du risque de 51 %, IC à 95 % : (34 à 63 %)]. Comparé au placebo, PROSCAR 5mg a été associé à un risque significativement plus faible de chirurgie [10,1% pour le placebo vs 4,6% pour PROSCAR ; 55 % de réduction du risque, IC 95 % : (37 à 68 %)] et avec un risque significativement plus faible de rétention urinaire aiguë [6,6 % pour le placebo vs 2,8 % pour PROSCAR ; 57 % de réduction du risque, IC à 95 % : (34 à 72 %)] ; voir les figures 2 et 3.
Figure 2 Pourcentage de patients subissant une intervention chirurgicale pour l'HBP, y compris la TURP
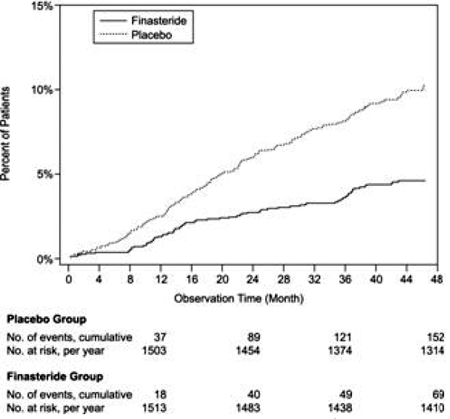
Figure 3 Pourcentage de patients développant une rétention urinaire aiguë (spontanée et précipitée)
Effet sur le débit urinaire maximal
Chez les patients du PLESS qui sont restés sous traitement pendant toute la durée de l'étude et qui disposaient de données évaluables sur le débit urinaire, PROSCAR 5 mg a augmenté le débit urinaire maximal de 1,9 ml/s contre 0,2 ml/s dans le groupe placebo.
Il y avait une nette différence entre les groupes de traitement en ce qui concerne le débit urinaire maximal en faveur de PROSCAR 5 mg au mois 4 (1,0 vs 0,3 mL/sec) qui s'est maintenu tout au long de l'étude. Dans les études antérieures d'un an, l'augmentation du débit urinaire maximal était comparable à celle du PLESS et s'est maintenue tout au long de la première année et tout au long de 5 années supplémentaires d'études d'extension ouvertes.
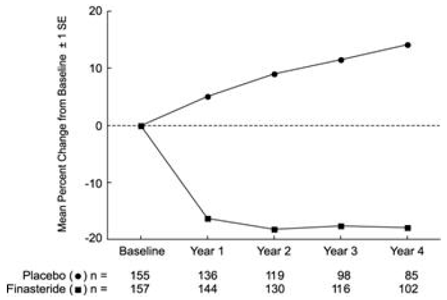
Effet sur le volume de la prostate
Dans PLESS, le volume de la prostate a été évalué chaque année par imagerie par résonance magnétique (IRM) chez un sous-ensemble de patients. Chez les patients traités par PROSCAR 5 mg qui sont restés sous traitement, le volume de la prostate a été réduit par rapport au départ et au placebo tout au long de l'étude de 4 ans. PROSCAR a diminué le volume de la prostate de 17,9 % (de 55,9 cc au départ à 45,8 cc à 4 ans) par rapport à une augmentation de 14,1 % (de 51,3 cc à 58,5 cc) dans le groupe placebo (p
Les résultats observés dans les études antérieures étaient comparables à ceux observés dans le PLESS. Le volume moyen de la prostate au départ variait entre 40 et 50 cc. La réduction du volume de la prostate a été observée au cours de la première année et s'est maintenue tout au long des cinq années supplémentaires d'études d'extension ouvertes.
Figure 4 Volume de la prostate dans PLESS
Le volume de la prostate comme prédicteur de la réponse thérapeutique
Une méta-analyse combinant les données d'un an de sept études en double aveugle contrôlées par placebo de conception similaire, incluant 4 491 patients atteints d'HBP symptomatique, a démontré que, chez les patients traités par PROSCAR, l'ampleur de la réponse des symptômes et le degré d'amélioration de la le débit urinaire était plus élevé chez les patients avec une hypertrophie de la prostate au départ.
Combinaison avec la thérapie alpha-bloquante
L'essai MTOPS (Medical Therapy of Prostatic Symptoms) était une étude en double aveugle, randomisée, contrôlée par placebo, multicentrique, d'une durée de 4 à 6 ans (moyenne de 5 ans) menée auprès de 3047 hommes atteints d'HBP symptomatique, qui ont été randomisés pour recevoir PROSCAR 5 mg/jour (n=768), la doxazosine 4 ou 8 mg/jour (n=756), l'association de PROSCAR 5 mg/jour et doxazosine 4 ou 8 mg/jour (n=786), ou le placebo (n=737 ). Tous les participants ont subi une titration hebdomadaire de la doxazosine (ou de son placebo) de 1 à 2 à 4 à 8 mg/jour. Seuls ceux qui ont toléré le niveau de dose de 4 ou 8 mg ont été maintenus sous doxazosine (ou son placebo) dans l'étude. La dose finale tolérée du participant (soit 4 mg ou 8 mg) a été administrée à partir de la fin de la semaine 4. La dose finale de doxazosine a été administrée une fois par jour, au coucher.
L'âge moyen des patients lors de la randomisation était de 62,6 ans (±7,3 ans). Les patients étaient de race blanche (82 %), afro-américains (9 %), hispaniques (7 %), asiatiques (1 %) ou amérindiens (
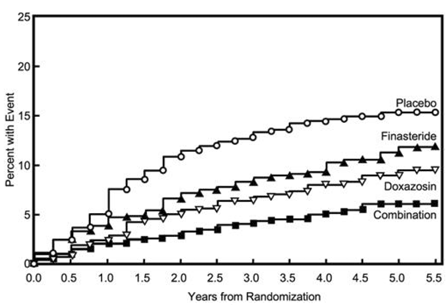
Le critère d'évaluation principal était une mesure composite de la première occurrence de l'un des cinq critères de jugement suivants : une augmentation confirmée de ≥ 4 points par rapport à l'état initial du score des symptômes, une rétention aiguë d'urine, une insuffisance rénale liée à l'HBP (augmentation de la créatinine), des infections récurrentes des voies urinaires ou urosepsie ou incontinence. Comparativement au placebo, le traitement par PROSCAR 5 mg, la doxazosine ou une thérapie combinée a entraîné une réduction du risque de subir l'un de ces cinq événements de 34 % (p = 0,002), 39 % (p
La majorité des événements (274 sur 351 ; 78 %) étaient une augmentation confirmée de ≥ 4 points du score des symptômes, appelée progression du score des symptômes. Le risque de progression du score des symptômes a été réduit de 30 % (p = 0,016), 46 % (p
Figure 5 Incidence cumulée d'une augmentation de 4 points du score des symptômes AUA par groupe de traitement
Le traitement par PROSCAR 5 mg, la doxazosine ou l'association de PROSCAR avec la doxazosine a réduit le score moyen des symptômes par rapport au départ à l'année 4. Le tableau 7 présente la variation moyenne par rapport au départ du score des symptômes AUA par groupe de traitement pour les patients qui sont restés sous traitement pendant quatre ans.
Les résultats de MTOPS sont cohérents avec les conclusions de l'étude contrôlée par placebo de 4 ans PLESS [voir Monothérapie ] en ce que le traitement par PROSCAR réduit le risque de rétention urinaire aiguë et la nécessité d'une intervention chirurgicale liée à l'HBP. Dans l'étude MTOPS, le risque de développer une rétention urinaire aiguë a été réduit de 67 % chez les patients traités par PROSCAR par rapport aux patients traités par placebo (0,8 % pour PROSCAR et 2,4 % pour le placebo). De plus, le risque de nécessiter un traitement invasif lié à l'HBP a été réduit de 64 % chez les patients traités par PROSCAR par rapport aux patients traités par placebo (2,0 % pour PROSCAR 5 mg et 5,4 % pour le placebo).
Résumé des études cliniques
Les données de ces études, montrant une amélioration des symptômes liés à l'HBP, une réduction des échecs thérapeutiques (événements urologiques liés à l'HBP), une augmentation des débits urinaires maximaux et une diminution du volume de la prostate, suggèrent que PROSCAR arrête le processus pathologique de l'HBP chez les hommes atteints d'une prostate hypertrophiée.
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au AVERTISSEMENTS ET PRECAUTIONS section.
